10×BN轉膜緩沖液
|
産品編号
|
産品名稱
|
規格
|
|
BC600P
|
10×BN轉膜緩沖液(粉末)
|
1升
|
● 簡介:
10×BN轉膜緩沖液(10×Blue Native Transfer Buffer)适用于BN蛋白(bái)電泳後凝膠上非變性蛋白(bái)的轉膜。本轉膜液配制便捷,稀釋後無需調節pH值,pH約爲7.5-7.7。該緩沖液最終可(kě)配成10升即用型1×緩沖液(根據需求補加甲醇)。
● 保存和運輸:
粉末裝常溫保存,常溫運輸,兩年(nián)有效;配成10×轉膜緩沖液後4℃貯存,一年(nián)有效;加入甲醇的即用型轉膜緩沖液4℃貯存,一個月有效。
● 配制方法:
将10×轉膜緩沖液粉末全部溶解于1升超純水中,徹底溶解,即配成10×轉膜緩沖液。
根據下表配制成1×即用型轉膜緩沖液
|
|
1×即用型轉膜緩沖液
|
|
|
500 ml
|
1 L
|
2 L
|
|
10×轉膜緩沖液
|
50 ml
|
100 ml
|
200 ml
|
|
無水甲醇
|
甲醇終濃度0-20%
|
|
超純水
|
定容至 500 ml
|
定容至 1升
|
定容至 2升
|
|
|
不要調節pH
|
注:轉膜緩沖液中加入甲醇對蛋白(bái)有固定作(zuò)用,轉膜分(fēn)子量較大(dà)的蛋白(bái)少加或不加甲醇,轉膜分(fēn)子量較小的蛋白(bái)要加至多20%的甲醇。非變性蛋白(bái)的轉膜可(kě)以不加甲醇。
● 使用方法:
1. BN電泳介紹:
Blue Native PAGE(BN-PAGE)是一種從(cóng)生(shēng)物樣品(質膜,胞漿等)中分(fēn)離(lí)分(fēn)子量10 kD-10 M kD 範圍的蛋白(bái)質複合物的電泳技術(shù)。其原理(lǐ)是用溫和去(qù)污劑(如(rú) DDM,digitonin)将蛋白(bái)複合體(tǐ)從(cóng)細胞膜中以近似天然的狀态分(fēn)離(lí)出來(lái),Blue Native PAGE (BN-PAGE)是用考馬斯亮藍 G-250 代替 SDS與蛋白(bái)結合而使其帶負電荷,根據蛋白(bái)分(fēn)子量不同在 PAGE膠中得(de)到分(fēn)離(lí)。BN-PAGE由于考馬斯亮藍G-250存在,使蛋白(bái)都(dōu)覆蓋上負電荷,可(kě)以分(fēn)離(lí)堿性蛋白(bái)(pI>7)。BN電泳可(kě)以選擇Blue/Clear 非變性凝膠電泳試劑盒(U型闆3-12%預制膠,通用型)(貨号:RTD6139-0312或RTD6139-0416)
2. 電泳後凝膠預處理(lǐ)(可(kě)選步驟):
凝膠浸泡于适量1×即用型BN轉膜緩沖液(加終濃度0.1% SDS)中,搖床慢(màn)搖10分(fēn)鍾。
注:凝膠浸泡在含SDS緩沖液中,能讓蛋白(bái)帶上更多的負電荷,有利于蛋白(bái)的轉膜。
3. 轉膜:
3.1轉膜方法:BN電泳後的轉膜建議(yì)用濕轉法。
3.2膜的選擇:BN電泳轉膜必須使用PVDF膜,不能用NC膜(NC膜會與考馬斯亮藍G-250不可(kě)逆結合,很難清除幹淨)。根據蛋白(bái)大(dà)小選擇膜的孔徑。一般說(shuō)來(lái),大(dà)于20 kD蛋白(bái)選擇0.45 μm孔徑,低于20 kD選擇0.22 μm孔徑。PVDF膜使用前要用無水甲醇潤濕活化。
3.3 三明治結構:轉膜三明治結構與傳統轉膜相(xiàng)同,即根據“黑(hēi)膠白(bái)膜”制作(zuò)三明治,即膜置于轉膜夾芯正極一側,凝膠置于轉膜夾芯負極一側,這樣凝膠上帶負電荷的蛋白(bái)才能轉移到膜上。
蛋白(bái)轉膜三明治制作(zuò):
負極(電轉夾黑(hēi)色面)-海綿墊-1層1 mm厚度濾紙-凝膠-膜-1層1 mm厚度濾紙-海綿墊-正
極(電轉夾白(bái)色面)
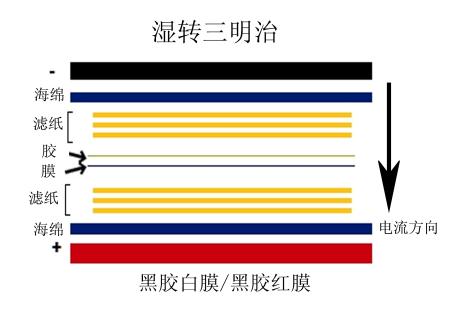
3.4 轉膜條件(jiàn):
由于在非變性條件(jiàn)下,不同蛋白(bái)的空間結構,聚合狀态,電荷數量都(dōu)有不同,以下轉膜條件(jiàn)僅供參考,客戶針對自(zì)己的目的蛋白(bái),最好經過1-2次預實驗後,确定最佳的轉膜條件(jiàn)。
|
蛋白(bái)大(dà)小
|
穩流
|
建議(yì)時間
|
降溫措施
|
|
低于70kD
|
150 mA
|
1 小時
|
不需要
|
|
70-300 kD
|
200 mA
|
1.5-2 小時
|
需要
|
|
高于300 kD
|
200 mA
|
2.5-3.5 小時
|
需要
|
4. 洗膜:
PVDF膜用無水甲醇清洗10分(fēn)鍾,徹底去(qù)除藍色G250。
5. 進行後續WB操作(zuò):封閉-一抗-二抗-檢測。