SDS裂解液
● 産品包裝:
|
貨号
|
名稱
|
規格
|
|
RL1060
|
SDS裂解液
|
100
ml
|
● 産品簡介:
SDS裂解液(SDS Lysis Buffer)是一種比較強烈的細胞組織裂解液,其主要成分(fēn)是Tris (pH8.0), SDS,EDTA等。SDS裂解液裂解得(de)到的蛋白(bái)樣品可(kě)以用于常規的Western、ChIP(染色質免疫共沉澱,chromatin immunoprecipitation)等。由于SDS裂解液有較強的裂解能力,IP或Co-IP實驗不建議(yì)使用該裂解液。由于含有較高濃度的SDS等幹擾物質,不能用傳統Bradford法測定由本裂解液裂解得(de)到樣品的蛋白(bái)濃度,可(kě)以使用BCA蛋白(bái)濃度測定試劑盒(貨号:RTP7102)或Bradford蛋白(bái)濃度測定試劑盒(去(qù)垢劑兼容型)(貨号:RTP7104)測定蛋白(bái)濃度。
● 貯存、效期及運輸:
常溫保存;有效期2年(nián);常溫運輸。
● 注意事(shì)項:
1. 需自(zì)備蛋白(bái)酶抑制劑如(rú)PMSF。
2. 如(rú)果使用本SDS裂解液用于ChIP實驗,在對超聲後基因組DNA大(dà)小進行檢測時,如(rú)果采用瓊脂糖凝膠中添加花菁素類染料如(rú)GelRed或類似染料或使用含該類染料的DNA上樣緩沖液時,由于電泳時SDS會與此類染料結合形成異常條帶,條帶通常在600-1000 bp左右,因此會對超聲後基因組DNA大(dà)小的判斷造成一定的影(yǐng)響。建議(yì)采用後染方法即“電泳完畢後對瓊脂糖凝膠染色”的方式進行條帶大(dà)小的檢測,使用該方法不會有異常條帶出現,不影(yǐng)響對超聲後基因組DNA大(dà)小的判斷,而且條帶大(dà)小更準确。
● 使用說(shuō)明:
1. 準備SDS裂解液:
取适當量的裂解液,在使用前數分(fēn)鍾内加入1/100體(tǐ)積的100 mM PMSF(貨号:PM1790),使PMSF的最終濃度爲1 mM或加入其他(tā)蛋白(bái)酶抑制劑。
注:SDS裂解液低溫會析出結晶,以下操作(zuò)需保持常溫操作(zuò)。
2. 細胞蛋白(bái)提取:
2.1 貼壁細胞:去(qù)除培養液,加入适量1×PBS,輕柔漂洗一遍,不要擾動貼壁細胞。按照(zhào)6孔闆每孔加入100-200 μl裂解液的比例加入裂解液,移液器吹打數下,使裂解液和細胞充分(fēn)接觸,用細胞刮刀刮下細胞收集于1.5 ml離(lí)心管中。
|
培養闆規格/培養皿表面積
|
細胞量
|
裂解液推薦使用量
|
|
100 mm培養皿
|
1.5×107
|
0.5-1 ml
|
|
60 mm培養皿
|
5×106
|
0.25-0.5 ml
|
|
35 mm培養皿
|
2×106
|
0.2-0.4 ml
|
|
6孔闆
|
2.5×106
|
100-200 μl
|
|
24孔闆
|
5×105
|
100-150 μl
|
|
96孔闆
|
1×105
|
50-100 μl
|
2.2 懸浮細胞:450 g 4℃ 離(lí)心5 min收集細胞;用适量1×PBS重懸細胞,450 g 4℃ 離(lí)心5 min收集細胞;重複漂洗細胞一次;按照(zhào)細胞沉澱體(tǐ)積(PCM)20 μl加入200 μl 裂解液的比例加入SDS裂解液,混勻細胞沉澱。
注:2×106 Jurkat細胞,其細胞沉澱體(tǐ)積(PCM,Packed Cell Volume)大(dà)約爲20 μl。
2.3 裂解細胞:
2.3.1 裂解混合物超聲波處理(lǐ)(超聲條件(jiàn)根據儀器調整);如(rú)沒有超聲破碎儀,可(kě)以使用注射器用27G針頭處理(lǐ)裂解物10-15次(貨号:PE2719 ,蛋白(bái)提取針頭套裝),以徹底裂解細胞。
注:裂解中細胞會釋放(fàng)出變性的核酸,呈團狀粘稠透明樣,如(rú)不進行超聲或針頭裂解處理(lǐ),會導緻裂解物非常粘稠,大(dà)大(dà)降低蛋白(bái)提取的得(de)率和純度。
2.3.2 裂解物95℃處理(lǐ)10分(fēn)鍾,間歇混勻。
2.4 離(lí)心收集上清:
充分(fēn)裂解後,常溫16000 g離(lí)心10分(fēn)鍾,取上清,即可(kě)進行後續的PAGE、Western等操作(zuò)。
3. 組織蛋白(bái)提取:
3.1 手術(shù)切除的組織塊迅速置于預冷(lěng)的生(shēng)理(lǐ)鹽水中,漂洗數次,洗淨組織血迹,用濾紙吸
幹組織表面液體(tǐ),将組織切成細小的碎片。
3.2 按照(zhào)每20 mg組織加入200 μl裂解液的比例加入裂解液。(如(rú)果裂解不充分(fēn)可(kě)以适當添加更多的裂解液,如(rú)果需要高濃度的蛋白(bái)樣品,可(kě)以适當減少裂解液的用量。)
3.3 用玻璃勻漿器勻漿5-10次,收集勻漿後的裂解混合物,超聲波處理(lǐ)(超聲條件(jiàn)根據儀器調整);如(rú)沒有超聲破碎儀,可(kě)以使用注射器用27G針頭處理(lǐ)裂解物10-15次(貨号:PE2719 ,蛋白(bái)提取針頭套裝),以徹底裂解細胞。
注:裂解中細胞會釋放(fàng)出變性的核酸,呈團狀粘稠透明樣,如(rú)不進行超聲或針頭裂解處理(lǐ),會導緻裂解物非常粘稠,大(dà)大(dà)降低蛋白(bái)提取的得(de)率和純度。
3.4 裂解物95℃處理(lǐ)10分(fēn)鍾,間歇混勻。
3.5 常溫16000 g離(lí)心10分(fēn)鍾,取上清,即可(kě)進行後續的PAGE、Western等操作(zuò)。
● 實驗示例:
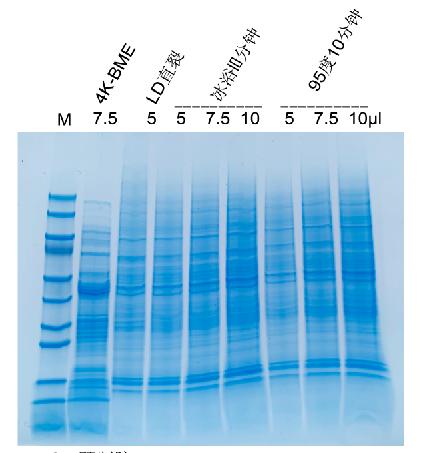
4-18% RealPAGE 預制膠
電泳條件(jiàn):1×TGS 穩壓200V
38-13mA 50min;染色:FastBlue蛋白(bái)染色液染色30min。
樣品1(LD直裂):2 ml K562細胞(6.5×106/ml),3000rpm
5min,沉澱用PBS清洗1次,離(lí)心後徹底去(qù)除PBS,加入130 μl超純水,100 μl5×loading
buffer(變性,還(hái)原),95度10 min,上樣5 μl。
樣品2(4K-BME):1 ml 4K細菌細胞(O/N培養),13000 rpm 5min,離(lí)心後徹底去(qù)除殘餘液體(tǐ),加入130 μl超純水,100 μl
5×loading buffer,95度10min,上樣7.5 μl。
樣品3:1 ml K562細胞(5×106/ml),3000 rpm 5
min,沉澱用PBS清洗1次,離(lí)心後徹底去(qù)除PBS,加入500 μl SDS裂解緩沖液,超聲處理(lǐ)(10%功率,開5S,關10S,2min),冰浴10 min或95度10min,間歇混勻,13000 rpm低溫離(lí)心10 min,取上清即爲總蛋白(bái)。加入5×loading
buffer(變性,還(hái)原)調整樣品濃度爲2 μg/μl,95度5min,上樣5,7.5和10 μl。