RealPure Animal Tissues/Cell RNA Extraction Kit
RealPure動物組織/細胞RNA提取試劑盒
● 試劑盒内容及保存:
|
試劑盒組成
|
RTR2306-01 (50次)
|
貯存方式
|
|
裂解液RL
|
30
ml
|
常溫
|
|
去(qù)蛋白(bái)液RD
|
30
ml
|
常溫
|
|
漂洗液RW(濃縮液)
|
25
ml
首次使用按照(zhào)标簽加入無水乙醇
|
常溫
|
|
RNase-free水
|
5
ml
|
4℃
|
|
DNA清除柱CS(RNase-free)
|
50個
|
常溫
|
|
RNA吸附柱CR(RNase-free)
|
50個
|
常溫
|
|
收集管
|
100個
|
常溫
|
|
2
ml離(lí)心管(RNase-free)
|
50個
|
常溫
|
|
1.5
ml離(lí)心管(RNase-free)
|
150個
|
常溫
|
|
說(shuō)明書(shū)
|
1份
|
|
● 儲存條件(jiàn)和效期:
RNase-free水4℃貯存;其他(tā)試劑在常溫(25℃左右)幹燥條件(jiàn)下,可(kě)保存1年(nián)。試劑盒常溫運輸。
● 産品簡介:
本試劑盒可(kě)從(cóng)動物組織中快(kuài)速提取總RNA,
可(kě)同時處理(lǐ)大(dà)量不同樣品。提取的總RNA純度高,沒有蛋白(bái)和其它雜質的污染,可(kě)用于RT-PCR、Real
Time RT-PCR、芯片分(fēn)析、Northern Blot、Dot
Blot、PolyA 篩選、體(tǐ)外翻譯、RNase
保護分(fēn)析和分(fēn)子克隆等多種下遊實驗。
● 準備工(gōng)作(zuò):
1操作(zuò)前在裂解液RL中加入β-巯基乙醇至終濃度1%,如(rú)1
ml RL中加入10 μl β-巯基乙醇。此裂解液最好現用現配。配好的
RL4 ℃可(kě)放(fàng)置3天。
2
按照(zhào)标簽所示在漂洗液RW中加入無水乙醇(自(zì)備),混勻後蓋緊瓶蓋後常溫貯存備用。
3
所有離(lí)心步驟均在常溫下進行。
● 操作(zuò)步驟:
1. 樣品處理(lǐ)和裂解:
1.1 貼壁細胞:
1.1.1直接裂解法:
不需胰酶消化,徹底吸幹淨培養液體(tǐ)後直接加推薦量裂解液 RL(使用前請(qǐng)先檢查是否已加入β-巯基乙醇)(下表)反複吹打細胞裂解,可(kě)以漩渦震蕩,直到看(kàn)不到細胞團爲止,進行步驟2。
|
培養器皿
|
底面積(cm2)
|
加培養液量 ml
|
可(kě)獲細胞量
|
裂解液RL加入體(tǐ)積
|
|
24孔培養闆
|
2
|
1
|
5×106
|
350 μl
|
|
3.5cm培養皿
|
8
|
3
|
2×106
|
350 μl
|
|
6孔培養闆
|
9.6
|
2.5
|
2.5×106
|
600 μl
|
|
6cm培養皿
|
21
|
5
|
5.2×106
|
600 μl
|
|
25cm培養皿
|
25
|
5
|
5.2×106
|
600 μl
|
|
100ml玻璃培養瓶
|
33
|
10
|
7×106
|
600 μl
|
1.1. 2 胰蛋白(bái)酶消化法:
确定細胞數量(收集細胞數量請(qǐng)不要超過1×107),吸除培養基,用PBS洗滌細胞,吸除PBS,向細胞中加入胰酶消化液處理(lǐ)細胞,當細胞脫離(lí)容器壁時,加入含有血清的培養基失活胰蛋白(bái)酶,将細胞溶液轉移至1.5 ml離(lí)心管中,300×g離(lí)心5
min,收集細胞沉澱,仔細吸除所有上清,加 350 μl(<5x106細胞)或 600 μl(5x106-1x107細胞)裂解液 RL(使用前請(qǐng)先檢查是否已加入β-巯基乙醇),反複吹打細胞裂解,可(kě)以漩渦震蕩,直到看(kàn)不到細胞團爲止,進行步驟2。
1.2 懸浮細胞:
300×g離(lí)心 5 min收集懸浮細胞(收集細胞數量請(qǐng)不要超過1×107)到一個1.5ml 離(lí)心管中,完全吸棄上清,加 350 μl(<5x106細胞)或 600 μl(5x106-1x107細胞)裂解液 RL(使用前請(qǐng)先檢查是否已加入β-巯基乙醇),反複吹打細胞裂解,可(kě)以漩渦震蕩,直到看(kàn)不到細胞團爲止,進行步驟2。
1.3 動物組織:
新鮮組織加入350
μl(<20mg 組織)或者
600 μl(20-30mg 組織)的裂解液RL(使用前請(qǐng)先檢查是否已加入β-巯基乙醇)後玻璃勻漿器或電動勻漿器将組織徹底研磨勻漿,進行步驟2。
注意:組織量一定不要超過30 mg,否則将導緻RNA得(de)率和質量下降。
背景知識:樣品處理(lǐ)量絕對不要超過DNA/RNA吸附柱處理(lǐ)能力,否則造成DNA/RNA殘留或者産量降低。不同組織細胞種類DNA/RNA相(xiàng)差極大(dà),例如(rú)胸腺脾髒DNA含量豐富,超過5 mg就(jiù)會超過柱子處理(lǐ)能力。COS細胞RNA含量豐富,超過3x106細胞就(jiù)會超過柱子吸附能力。所以開始摸索實驗條件(jiàn)時,如(rú)果不清楚樣品DNA/RNA含量時甯可(kě)使用較少的樣品處理(lǐ)量,如(rú)細胞不超過3-4x106,組織不超過10mg,随後根據實驗結果增加或者減少處理(lǐ)量。
2. 離(lí)心得(de)到上清:
若沒有不溶性沉澱,直接進行步驟3。如(rú)有不能裂解的碎片或者不溶物,13,000
rpm離(lí)心5 min, 取裂解物上清進行下一步。
3. 去(qù)除基因組污染和洗脫RNA:
将DNA清除柱CS放(fàng)入一幹淨的2 ml離(lí)心管内,用移液器小心将步驟1離(lí)心管内的溶液或步驟2離(lí)心後的上清全部轉移到DNA清除柱CS中,13,000
rpm離(lí)心2分(fēn)鍾(RNA在離(lí)心管濾液中,不要丢棄)。
注:确保全部溶液都(dōu)收集到2 ml離(lí)心管中,如(rú)果膜上有殘留液體(tǐ),延長離(lí)心時間至5分(fēn)鍾,保證膜上無殘留液體(tǐ)。
4. RNA挂柱:
向2 ml離(lí)心管濾液中加入0.5倍體(tǐ)積的無水乙醇(如(rú)濾液體(tǐ)積爲300 μl/600 μl,加入150
μl/300 μl無水乙醇),此時可(kě)能會出現沉澱,立即混勻,不要離(lí)心。将全部溶液加入到RNA吸附柱CR中(吸附柱放(fàng)入收集管中),13,000 rpm離(lí)心1分(fēn)鍾。
注:确保溶液全部過濾到收集管中,膜上無殘留,如(rú)有必要,可(kě)以延長離(lí)心時間至5分(fēn)鍾。
5. 去(qù)除RNA中的蛋白(bái)污染:
向RNA吸附柱CR中(吸附柱放(fàng)入收集管中)加入500 μl 去(qù)蛋白(bái)液RD,13,000
rpm離(lí)心1分(fēn)鍾,棄廢液。
6. 去(qù)除RNA中的其他(tā)雜質:
向RNA吸附柱CR中加入700
μl漂洗液RW(使用前請(qǐng)先檢查是否已加入乙醇), 13,000 rpm離(lí)心1分(fēn)鍾,棄廢液。
7. 進一步去(qù)除RNA中的其他(tā)雜質:
向吸附柱CR中加入500
μl漂洗液RW (使用前請(qǐng)先檢查是否已加入乙醇),13,000 rpm離(lí)心1
分(fēn)鍾,棄廢液。
8. 關鍵步驟:徹底去(qù)除吸附柱上的殘餘乙醇:
将吸附柱CR放(fàng)回收集管中,确保蓋好吸附柱管蓋,13,000 rpm将吸附柱CR空甩離(lí)心2 分(fēn)鍾,去(qù)除吸附柱上的殘餘液體(tǐ)。
注:此步驟目的是将吸附柱中殘餘漂洗液去(qù)除,如(rú)果有漂洗液殘留,可(kě)能會影(yǐng)響後續的RT等實驗操作(zuò)。
9. 洗脫得(de)到RNA:
将RNA吸附柱CR轉入一個新的1.5 ml RNase-free離(lí)心管中,向吸附柱O型墊圈中央懸空加入50-100 μl RNase-free水(事(shì)先65℃預熱(rè)可(kě)提高洗脫效率),蓋好吸附柱管蓋,常溫放(fàng)置2分(fēn)鍾,13,000
rpm離(lí)心2 分(fēn)鍾。
注:确保水要加到膜的中央,不要貼壁加入;洗脫緩沖液體(tǐ)積不應少于50 μl,體(tǐ)積過小影(yǐng)響回收效率。
10. RNA貯存:
RNA樣品-80℃中保存。
● RNA産量和質量的評估:
1. RNA産量:
用分(fēn)光(guāng)光(guāng)度計(jì)測定OD260的吸光(guāng)值來(lái)計(jì)算RNA産量。将RNA按照(zhào)一定的比例稀釋于TE溶液(10mMTris pH8.0,1mMEDTA)中,根據以下公式計(jì)算:
A260×稀釋倍數×40=μg
RNA/ml
注:測定OD值時,盡量不要用RNase-free水稀釋RNA,因爲RNase-free水pH較低,測定的OD值偏低。
2. RNA質量:
凝膠電泳檢測:凝膠電泳中,動物的完整RNA應該有兩條主帶:28S和18S,并且28S亮度應該與18S相(xiàng)當或是其亮度的2倍。可(kě)以使用普通的1×TAE瓊脂糖凝膠電泳,凝膠濃度1-1.5
%,可(kě)以使用高電壓,短(duǎn)時間電泳,如(rú)7V/cm電泳,20分(fēn)鍾。建
議(yì)使用D2000
DNA ladder(Cat:RTM415)作(zuò)爲Marker。28S
rRNA遷移率與1800bp類似,18S
rRNA遷移率與700bp類似。
吸光(guāng)值檢測:可(kě)以用A230,A260和A280的數值表示RNA的純度。純淨的RNA的
A260/A280比值應該爲2,我們得(de)到的RNA樣品比值應在1.8-2.2之間,如(rú)果比值低于1.8,表明RNA樣品中蛋白(bái)污染比較嚴重。A260/A230比值應該在2-2.2之間。如(rú)果此比值低于2,表明RNA樣品中有胍鹽的污染。
● 實驗示例:
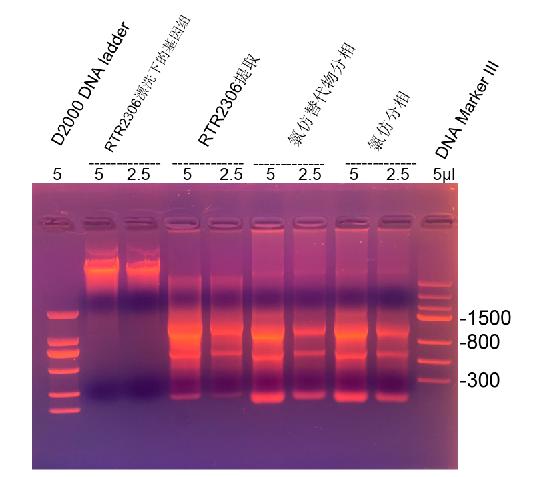
1.2%瓊脂糖膠 1×TAE 150V 25min
RealSafe Red預染
RNA提取試劑提取步驟:K562懸浮細胞,1 ml收集(6×106/ml),PBS漂洗兩遍,加入1 ml RNA提取試劑,懸浮後常溫靜(jìng)置10分(fēn)鍾,加入氯仿或氯仿替代物200 μl,徹底混勻後靜(jìng)置10分(fēn)鍾,自(zì)然分(fēn)相(xiàng),4度 13000 rpm 離(lí)心15分(fēn)鍾,上清中加入等體(tǐ)積異丙醇,常溫靜(jìng)置20分(fēn)鍾,4度 13000 rpm離(lí)心15分(fēn)鍾,沉澱用1 ml 75%乙醇漂洗,4度 8000rpm 離(lí)心2分(fēn)鍾,沉澱溶于50μl
RNase-free水中。
RTR2306操作(zuò)簡述如(rú)下:K562懸浮細胞,1ml收集(6×106/ml),PBS漂洗兩遍(平行做2管)。沉澱中加入350 μl 裂解液RL(已加β-ME),常溫裂解5分(fēn)鍾,裂解物加到DNA清除柱CS中,離(lí)心收集到2 ml離(lí)心管中,離(lí)心管中加入0.5倍體(tǐ)積無水乙醇,全部溶液加到RNA吸附柱CR中,離(lí)心,随後清除柱CS和RNA吸附柱CR一次RD漂洗,2次RW漂洗,最後每個吸附柱用50 μl
RNase-free水洗脫,合并兩管得(de)到100 μl RNA和100 μl去(qù)除的基因組DNA。
● 問(wèn)題指南(nán):
1. 離(lí)心柱發生(shēng)堵塞
離(lí)心柱發生(shēng)堵塞之後會造成 RNA 得(de)率降低甚至不能純化得(de)到 RNA。
常見(jiàn)原因分(fēn)析如(rú)下:
1.1組織或細胞破碎不徹底。
破碎不徹底會使吸附柱發生(shēng)堵塞,同時會影(yǐng)響 RNA 得(de)率及質量。我們建議(yì)在進行裂解時,盡量借助輔助手段如(rú)機(jī)械勻漿徹底破碎組織。
1.2 樣本初始量過多。
樣本使用量過多會導緻裂解液RL裂解細胞時不完全,導緻離(lí)心柱堵塞。該試劑盒處理(lǐ)樣本的初
始最大(dà)量107細胞或30 mg組織。
1.3 離(lí)心機(jī)的溫度過低。
整個 RNA 分(fēn)離(lí)純化所有的步驟均在常溫(20-25℃)進行。有些低溫離(lí)心機(jī)的溫度低于 20℃,可(kě)能會造成離(lí)心柱的堵塞。如(rú)果發生(shēng)這種現象,請(qǐng)将離(lí)心機(jī)溫度設置到
20-25℃。
2. 提取不到RNA或者RNA産量低
通常會有多種因素影(yǐng)響回收效率,比如(rú):樣本 RNA 含量、操作(zuò)方法、洗脫體(tǐ)積等。
常見(jiàn)原因分(fēn)析:
2.1 樣本保存不當或樣本保存時間過久導緻RNA 已經降解。
建議(yì):新采集的樣本應立即放(fàng)入液氮中速凍,長期保存于-70℃并避免樣本的反複凍融;或者将樣本立即浸泡在 RNA 穩定劑RNAwait溶液中。
2.2 樣本破碎裂解不充分(fēn)導緻純化柱堵塞。
建議(yì):參見(jiàn)1。
2.3 洗脫液添加不正确。
建議(yì):确認 RNase-Free 水滴加到了純化柱膜O型墊圈中央位置。
2.4 漂洗液RW中沒有添加正确體(tǐ)積的無水乙醇。
建議(yì):請(qǐng)按照(zhào)說(shuō)明書(shū),在試劑盒使用前,漂洗液RW中添加正确體(tǐ)積的無水乙醇并混勻。
2.5 組織樣本用量不合适。
建議(yì):每 600 μl 裂解液RL使用最大(dà)細胞量爲1×107,使用最大(dà)組織量爲30
mg,過多會導緻
RNA 提取量降低并且得(de)到的
RNA 純度也會降低。我們強烈建議(yì)每單次
RNA提取操作(zuò),樣本初始用量一定不要超過最大(dà)建議(yì)量。
2.6 洗脫體(tǐ)積不合适或洗脫不徹底。
建議(yì):純化柱的洗脫液體(tǐ)積爲 50-100 μl;若洗脫效果并不理(lǐ)想,建議(yì)在加入65℃預熱(rè)的RNase-Free 水後,延長常溫放(fàng)置的時間,例如(rú)放(fàng)置
5-10 min。
2.7 純化柱在第二次RW洗滌之後有乙醇殘留。
建議(yì):漂洗液RW洗滌後,吸附柱空甩離(lí)心2 min是關鍵步驟,以充分(fēn)除去(qù)吸附柱上殘留的乙醇。
3. 純化獲得(de)的RNA有降解
純化得(de)到的 RNA 的質量和樣本的保存、RNase 污染、操作(zuò)等因素有關。
常見(jiàn)原因分(fēn)析:
3.1 組織樣本采集後沒有及時保存。
建議(yì):組織樣本在收集後若不及時使用,請(qǐng)立即低溫保存于液氮中或經液氮速凍後立即轉移至-70℃
長期保存,或者将樣本立即浸泡在 RNA 穩定劑 RNAwait溶液中。提取 RNA 請(qǐng)盡量使用新近采取的組織樣本。
3.2 組織樣本反複凍融。
建議(yì):組織樣本保存時,最好分(fēn)裝成小份,使用時取出其中一份即可(kě),避免樣本的反複凍融導緻 RNA 的降解。
3.3 操作(zuò)間有 RNase 引入或沒有佩戴一次性手套、口罩等。
建議(yì):RNA 提取實驗最好在單獨的 RNA 操作(zuò)間進行,并在實驗前清理(lǐ)好實驗桌,實驗時佩戴一次性手套、口罩,最大(dà)程度上避免
RNase 引入導緻的RNA
降解。
3.4 試劑在使用過程中被 RNase 污染。
建議(yì):更換新的提取試劑盒進行相(xiàng)關實驗。
3.5 RNA 操作(zuò)時所用的離(lí)心管、槍頭等有 RNase 污染。
建議(yì):确認 RNA 提取時所用到的離(lí)心管、槍頭、移液器等都(dōu)是 RNase-Free。
4. RNA中含有DNA污染
4.1 提取的起始材料量超過最大(dà)建議(yì)量
建議(yì):步驟1-樣品處理(lǐ)時使用107細胞或30
mg組織,不要超過最大(dà)處理(lǐ)量,否則樣品的核酸量會超過DNA清除柱CS的處理(lǐ)極限,導緻洗脫下的RNA有基因組DNA的污染。
4.2 省略了步驟3-去(qù)除基因組污染步驟。
建議(yì):步驟3-去(qù)除基因組污染步驟必不可(kě)少,不能省略。DNA清除柱CS能極大(dà)限度的去(qù)除上清液中的基因組
DNA,使用裂解液RL洗脫下的RNA基本無基因組DNA的污染。
4.3 跳(tiào)過了使用去(qù)蛋白(bái)液RD的漂洗步驟(見(jiàn)操作(zuò)步驟第5步)。
建議(yì):這一步驟對于除去(qù)殘留的 DNA 以及雜質蛋白(bái)十分(fēn)重要,一定不能省略,否則将會導緻純化得(de)到的
RNA 中含有DNA
污染和蛋白(bái)污染。
5. 純化獲得(de)的RNA影(yǐng)響下遊實驗
經吸附柱純化的 RNA,如(rú)果鹽離(lí)子、蛋白(bái)質含量過多會影(yǐng)響下遊實驗,比如(rú):逆轉錄、Northern
Blot 等。
1. 洗脫後的 RNA 有鹽離(lí)子殘留。
建議(yì):确認漂洗液RW中添加了正确體(tǐ)積的乙醇,并按操作(zuò)說(shuō)明的離(lí)心轉速進行2次RW洗滌吸附柱 (見(jiàn)操作(zuò)步驟第6,7步)。
2. 洗脫後的 RNA 有乙醇殘留。
建議(yì):确認 RW第二次洗滌後,按操作(zuò)說(shuō)明的對吸附柱進行空管離(lí)心操作(zuò)(見(jiàn)操作(zuò)步驟第8 步),如(rú)果還(hái)有乙醇殘留,可(kě)以将空管離(lí)心後吸附柱開蓋常溫放(fàng)置 5 min,以最大(dà)程度上去(qù)除