RealPure Bacterial RNA Extraction Kit
RealPure細菌RNA提取試劑盒
● 試劑盒内容及保存:
|
試劑盒組成
|
RTR2307
(50次)
|
貯存方式
|
|
TE
pH8.0
|
10
ml
|
常溫
|
|
溶菌酶
|
50
mg
首次使用按照(zhào)标簽加入TE
pH8.0
|
4℃
加入TE後-20℃貯存
|
|
裂解液RL
|
30
ml
|
常溫
|
|
去(qù)蛋白(bái)液RD
|
30
ml
|
常溫
|
|
漂洗液RW(濃縮液)
|
25
ml
首次使用按照(zhào)标簽加入無水乙醇
|
常溫
|
|
RNase-free水
|
5
ml
|
4℃
|
|
DNA清除柱CS(RNase-free)
|
50個
|
常溫
|
|
RNA吸附柱CR(RNase-free)
|
50個
|
常溫
|
|
收集管
|
100個
|
常溫
|
|
2
ml離(lí)心管(RNase-free)
|
50個
|
常溫
|
|
1.5
ml離(lí)心管(RNase-free)
|
150個
|
常溫
|
|
說(shuō)明書(shū)
|
1份
|
|
● 儲存條件(jiàn)和效期:
RNase-free水和溶菌酶4℃保存;其他(tā)試劑在常溫(25℃左右)幹燥條件(jiàn)下,可(kě)保存1年(nián)。試劑盒常溫運輸。
● 産品簡介:
本試劑盒适用于快(kuài)速提取細菌總RNA,使用DNA清除柱CS确保有效濾除gDNA殘留,不需要使用DNase消化,得(de)到的RNA可(kě)直接用于反轉錄PCR,熒光(guāng)定量PCR.。
● 準備工(gōng)作(zuò):
1操作(zuò)前在裂解液RL中加入β-巯基乙醇至終濃度1%,如(rú)500
μl RSL中加入5 μl β-巯基乙醇。此裂解液最好現用現配。配好的
RSL4 ℃可(kě)放(fàng)置3天。
2
按照(zhào)标簽所示在漂洗液RW中加入無水乙醇(自(zì)備),混勻後蓋緊瓶蓋後常溫貯存備用。
3
按照(zhào)标簽所示在溶菌酶中加入TE溶液,混勻溶解後-20℃貯存。
4
所有離(lí)心步驟均在常溫下進行。
● 操作(zuò)步驟:
1. 樣品處理(lǐ)和裂解:
1.1 1-2 ml菌液(約108-109細胞)加入到1.5
ml離(lí)心管中,13000 rpm 離(lí)心2
分(fēn)鍾,棄上清,離(lí)心快(kuài)甩,用移液器吸頭盡可(kě)能吸盡上清(如(rú)果培養基上清去(qù)除不完全,将對細胞壁的酶解消化過程産生(shēng)抑制)。
注:E.coli菌株OD600 =0.5 相(xiàng)當于1×109個細菌。
1.2
菌體(tǐ)中加入100 μl酶溶液,渦旋震蕩20秒,
按照(zhào)下表處理(lǐ)。
|
細菌種類
|
酶溶液
|
處理(lǐ)
|
|
|
革蘭氏陰性菌
|
大(dà)腸杆菌
|
1 mg/ml 溶菌酶TE溶液
|
常溫5 min
|
10mg/ml 溶菌酶用TE稀釋10倍
|
|
革蘭氏陽性菌
|
枯草杆菌
|
10 mg/ml 溶菌酶TE溶液
|
常溫15 min
|
試劑盒配套
|
|
金黃(huáng)色葡萄球菌
|
1mg/ml 溶葡球菌酶(lysostaphin)
|
37℃ 15 min
|
自(zì)備
|
注:不同細菌破壁難易程度不同,客戶根據細菌種類選擇合适的酶種類和破壁程序。
1.3 酶解後的菌體(tǐ)中加入500 μl裂解液RL(使用前請(qǐng)先檢查是否已加入β-巯基乙醇),混勻。
2. 離(lí)心得(de)到上清(可(kě)選步驟):
若沒有不溶性沉澱,直接進行步驟3。如(rú)有不能裂解的碎片或者不溶物,13,000
rpm離(lí)心5 min, 取裂解物上清進行下一步。
3. 去(qù)除基因組污染和洗脫RNA:
将DNA清除柱CS放(fàng)入一幹淨的2 ml離(lí)心管内,用移液器小心将步驟2離(lí)心管内的溶液或離(lí)心後的上清全部轉移到DNA清除柱CS中,13,000
rpm離(lí)心2分(fēn)鍾(RNA在離(lí)心管濾液中,不要丢棄)。
注:确保全部溶液都(dōu)收集到2 ml離(lí)心管中,如(rú)果膜上有殘留液體(tǐ),延長離(lí)心時間至5分(fēn)鍾,保證膜上無殘留液體(tǐ)。
4. RNA挂柱:
向2 ml離(lí)心管濾液中加入0.5倍體(tǐ)積的無水乙醇(如(rú)濾液體(tǐ)積爲500 μl,加入250
μl無水乙醇),此時可(kě)能會出現沉澱,立即混勻,不要離(lí)心。将全部溶液加入到RNA吸附柱CR中(吸附柱放(fàng)入收集管中),13,000 rpm離(lí)心1分(fēn)鍾。
注:确保溶液全部過濾到收集管中,膜上無殘留,如(rú)有必要,可(kě)以延長離(lí)心時間至5分(fēn)鍾。
5. 去(qù)除RNA中的蛋白(bái)污染:
向RNA吸附柱CR中(吸附柱放(fàng)入收集管中)加入500 μl 去(qù)蛋白(bái)液RD,13,000
rpm離(lí)心1分(fēn)鍾,棄廢液。
6. 去(qù)除RNA中的其他(tā)雜質:
向RNA吸附柱CR中加入700
μl漂洗液RW(使用前請(qǐng)先檢查是否已加入乙醇), 13,000 rpm離(lí)心1分(fēn)鍾,棄廢液。
7. 進一步去(qù)除RNA中的其他(tā)雜質:
向吸附柱CR中加入500
μl漂洗液RW (使用前請(qǐng)先檢查是否已加入乙醇),13,000 rpm離(lí)心1
分(fēn)鍾,棄廢液。
8. 關鍵步驟:徹底去(qù)除吸附柱上的殘餘乙醇:
将吸附柱CR放(fàng)回收集管中,确保蓋好吸附柱管蓋,13,000 rpm将吸附柱CR空甩離(lí)心2 分(fēn)鍾,去(qù)除吸附柱上的殘餘液體(tǐ)。
注:此步驟目的是将吸附柱中殘餘漂洗液去(qù)除,如(rú)果有漂洗液殘留,可(kě)能會影(yǐng)響後續的RT等實驗操作(zuò)。
9. 洗脫得(de)到RNA:
将RNA吸附柱CR轉入一個新的1.5 ml RNase-free離(lí)心管中,向吸附柱O型墊圈中央懸空加入50-100 μl RNase-free水(事(shì)先65℃預熱(rè)可(kě)提高洗脫效率),蓋好吸附柱管蓋,常溫放(fàng)置2分(fēn)鍾,13,000
rpm離(lí)心2 分(fēn)鍾。
注:确保水要加到膜的中央,不要貼壁加入;洗脫緩沖液體(tǐ)積不應少于50 μl,體(tǐ)積過小影(yǐng)響回收效率。
10. RNA貯存:
RNA樣品-80℃中保存。
● RNA産量和質量的評估:
1. RNA産量:
用分(fēn)光(guāng)光(guāng)度計(jì)測定OD260的吸光(guāng)值來(lái)計(jì)算RNA産量。将RNA按照(zhào)一定的比例稀釋于TE溶液(10mMTris pH8.0,1mMEDTA)中,根據以下公式計(jì)算:
A260×稀釋倍數×40=μg
RNA/ml
注:測定OD值時,盡量不要用RNase-free水稀釋RNA,因爲RNase-free水pH較低,測定的OD值偏低。
大(dà)腸杆菌DH5α RNA得(de)率爲20-30μg/ml 菌液OD600=0.5
2. RNA質量:
凝膠電泳檢測:凝膠電泳中,細菌的完整RNA應該有兩條主帶:26S和13S,并且26S亮度應該與13S相(xiàng)當或是其亮度的2倍。可(kě)以使用普通的1×TAE瓊脂糖凝膠電泳,凝膠濃度1-1.5
%,可(kě)以使用高電壓,短(duǎn)時間電泳,如(rú)7V/cm電泳,20分(fēn)鍾。建議(yì)使用D2000
DNA ladder(Cat:RTM415)作(zuò)爲Marker。細菌26S
rRNA遷移率與800bp類似,13S
rRNA遷移率與700bp類似。
吸光(guāng)值檢測:可(kě)以用A230,A260和A280的數值表示RNA的純度。純淨的RNA的
A260/A280比值應該爲2,我們得(de)到的RNA樣品比值應在1.8-2.2之間,如(rú)果比值低于1.8,表明RNA樣品中蛋白(bái)污染比較嚴重。A260/A230比值應該在2-2.2之間。如(rú)果此比值低于2,表明RNA樣品中有胍鹽的污染。
● 實驗示例:
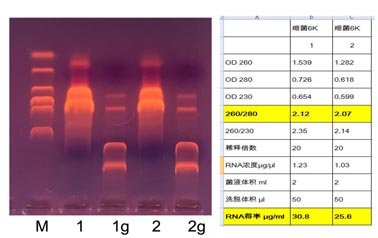
細菌DH5α RNA
1,3 使用DNA清除柱後得(de)到的RNA
1g,2g
DNA清除柱洗脫後殘餘的RNA和DNA
1% 瓊脂糖凝膠 1×TAE 150V 20min
M D2000 DNA ladder
2
ml 過夜菌,50 μl洗脫,上樣5 μl
|
● 問(wèn)題指南(nán):
1. 離(lí)心柱發生(shēng)堵塞
離(lí)心柱發生(shēng)堵塞之後會造成 RNA 得(de)率降低甚至不能純化得(de)到 RNA。
常見(jiàn)原因分(fēn)析如(rú)下:
1.1細菌破碎不徹底。
細菌破碎不徹底會使吸附柱發生(shēng)堵塞,同時會影(yǐng)響 RNA 得(de)率及質量。我們建議(yì)在進行細菌破壁時,盡量破碎細菌的細胞壁、細胞膜等組織。
1.2 樣本初始量過多。
樣本使用量過多會導緻裂解液RL plus裂解細胞時不完全,導緻離(lí)心柱堵塞。該試劑盒處理(lǐ)樣本的初始最大(dà)量108-109細菌細胞。
1.3 離(lí)心機(jī)的溫度過低。
整個 RNA 分(fēn)離(lí)純化所有的步驟均在常溫(20-25℃)進行。有些低溫離(lí)心機(jī)的溫度低于 20℃,可(kě)能會造成離(lí)心柱的堵塞。如(rú)果發生(shēng)這種現象,請(qǐng)将離(lí)心機(jī)溫度設置到
20-25℃。
2. 提取不到RNA或者RNA産量低
通常會有多種因素影(yǐng)響回收效率,比如(rú):樣本 RNA 含量、操作(zuò)方法、洗脫體(tǐ)積等。
常見(jiàn)原因分(fēn)析:
2.1 樣本保存不當或樣本保存時間過久導緻RNA 已經降解。
建議(yì):新采集的樣本應立即放(fàng)入液氮中速凍,長期保存于-70℃并避免樣本的反複凍融;或者将樣本立即浸泡在 RNA 穩定劑RNAwait溶液中。
2.2 樣本破碎裂解不充分(fēn)導緻純化柱堵塞。
建議(yì):溶菌酶破壁時,确保破壁完全。革蘭氏陽性菌注意破壁溫度和時間。
2.3 洗脫液添加不正确。
建議(yì):确認 RNase-Free 水滴加到了純化柱膜O型墊圈中央位置。
2.4 漂洗液RW中沒有添加正确體(tǐ)積的無水乙醇。
建議(yì):請(qǐng)按照(zhào)說(shuō)明書(shū),在試劑盒使用前,漂洗液RW中添加正确體(tǐ)積的無水乙醇并混勻。
2.5 組織樣本用量不合适。
建議(yì):每 500 μl 裂解液RL使用最大(dà)細菌量109,使用過多會導緻
RNA 提取量降低并且得(de)到的
RNA 純度也會降低。我們強烈建議(yì)每單次
RNA提取操作(zuò),樣本初始用量一定不要超過最大(dà)建議(yì)量。
2.6 洗脫體(tǐ)積不合适或洗脫不徹底。
建議(yì):純化柱的洗脫液體(tǐ)積爲 50-100 μl;若洗脫效果并不理(lǐ)想,建議(yì)在加入65℃預熱(rè)的RNase-Free 水後,延長常溫放(fàng)置的時間,例如(rú)放(fàng)置
5-10 min。
2.7 純化柱在第二次RW洗滌之後有乙醇殘留。
建議(yì):漂洗液RW洗滌後,吸附柱空甩離(lí)心2 min是關鍵步驟,以充分(fēn)除去(qù)吸附柱上殘留的乙醇。
3. 純化獲得(de)的RNA有降解
純化得(de)到的 RNA 的質量和樣本的保存、RNase 污染、操作(zuò)等因素有關。
常見(jiàn)原因分(fēn)析:
3.1 組織樣本采集後沒有及時保存。
建議(yì):組織樣本在收集後若不及時使用,請(qǐng)立即低溫保存于液氮中或經液氮速凍後立即轉移至-70℃
長期保存,或者将樣本立即浸泡在 RNA 穩定劑 RNAwait溶液中。提取 RNA 請(qǐng)盡量使用新近采取的組織樣本。
3.2 組織樣本反複凍融。
建議(yì):組織樣本保存時,最好分(fēn)裝成小份,使用時取出其中一份即可(kě),避免樣本的反複凍融導緻 RNA 的降解。
3.3 操作(zuò)間有 RNase 引入或沒有佩戴一次性手套、口罩等。
建議(yì):RNA 提取實驗最好在單獨的 RNA 操作(zuò)間進行,并在實驗前清理(lǐ)好實驗桌,實驗時佩戴一次性手套、口罩,最大(dà)程度上避免
RNase 引入導緻的RNA
降解。
3.4 試劑在使用過程中被 RNase 污染。
建議(yì):更換新的植物總RNA 提取系列試劑盒進行相(xiàng)關實驗。
3.5 RNA 操作(zuò)時所用的離(lí)心管、槍頭等有 RNase 污染。
建議(yì):确認 RNA 提取時所用到的離(lí)心管、槍頭、移液器等都(dōu)是 RNase-Free。
4. RNA中含有DNA污染
4.1 提取的起始菌體(tǐ)量超過最大(dà)建議(yì)量
建議(yì):步驟1-樣品處理(lǐ)時使用108-109細菌,不要超過最大(dà)處理(lǐ)量,否則樣品的核酸量會超過DNA清除柱CS的處理(lǐ)極限,導緻洗脫下的RNA有基因組DNA的污染。
4.2 省略了步驟3-去(qù)除基因組污染步驟。
建議(yì):步驟3-去(qù)除基因組污染步驟必不可(kě)少,不能省略。DNA清除柱CS能極大(dà)限度的去(qù)除上清液中的基因組
DNA,使用裂解液RL
plus洗脫下的RNA基本無基因組DNA的污染。
4.3 跳(tiào)過了使用去(qù)蛋白(bái)液RD的漂洗步驟(見(jiàn)操作(zuò)步驟第5步)。
建議(yì):這一步驟對于除去(qù)殘留的 DNA 以及雜質蛋白(bái)十分(fēn)重要,一定不能省略,否則将會導緻純化得(de)到的
RNA 中含有DNA
污染和蛋白(bái)污染。
5. 純化獲得(de)的RNA影(yǐng)響下遊實驗
經吸附柱純化的 RNA,如(rú)果鹽離(lí)子、蛋白(bái)質含量過多會影(yǐng)響下遊實驗,比如(rú):逆轉錄、Northern
Blot 等。
1. 洗脫後的 RNA 有鹽離(lí)子殘留。
建議(yì):确認漂洗液RW中添加了正确體(tǐ)積的乙醇,并按操作(zuò)說(shuō)明的離(lí)心轉速進行2次RW洗滌吸附柱 (見(jiàn)操作(zuò)步驟第6,7步)。
2. 洗脫後的 RNA 有乙醇殘留。
建議(yì):确認 RW第二次洗滌後,按操作(zuò)說(shuō)明的對吸附柱進行空管離(lí)心操作(zuò)(見(jiàn)操作(zuò)步驟第8
步),如(rú)果還(hái)有乙醇殘留,可(kě)以将空管離(lí)心後吸附柱開蓋常溫放(fàng)置
5 min,以最大(dà)程度上去(qù)除乙醇殘留。