Tris緩沖液介紹
Tris-HCl緩沖液
注:原文爲“龍師(shī)兄實驗室”公衆号原創,略有修改。
Ver 730464
在生(shēng)化實驗中,除了常用的PB和PBS緩沖液,還(hái)經常用到THB和TBS緩沖液,那什麽是THB和TBS? THB是Tris-HCl Buffer的縮寫,中文翻譯爲“Tris-鹽酸緩沖液”,依靠Tris(堿)和HCl(酸)對溶液起到緩沖維持溶液pH值的作(zuò)用。實驗室經常稱呼爲Tris緩沖液或者Tris-HCl緩沖液,下文統一稱呼爲Tris緩沖液。
TBS是Tris Buffered Saline 的簡寫,中文通常稱爲“三羟甲基氨基甲烷緩沖鹽溶液”,更準确地譯名應該是“三羟甲基氨基甲烷緩沖生(shēng)理(lǐ)鹽水”,是生(shēng)化實驗廣泛使用的一種緩沖溶液。通常是在THB的基礎上加入0.9% NaCl(0.15 M),擁有和人(rén)體(tǐ)體(tǐ)液類似的滲透壓。常用于清洗免疫染色的組織或Western Blotting中的蛋白(bái)印迹膜等。有時爲了滿足其它需求,需加入Tween-20,這就(jiù)是常用的TBST(TBS with Tween-20)緩沖液。
Tris的曆史:
Tris初次引起廣泛注意的商業成功之一是在魚的運輸時降低了魚的死亡率。在20世紀40年(nián)代,活魚是在盛有海水的桶裡(lǐ)運往市場的。不幸的是,許多魚因CO2的積聚使pH下降而緻死。爲了解決這個問(wèn)題,在水中加入麻醉劑以便使魚的代謝活動降至最低限度,即使這樣也隻能部分(fēn)地得(de)到緩解。1958年(nián),McFarland和Norris在海水中加入Tris穩定其pH,的确降低了魚的死亡率。Tris有很高的緩沖能力,在水中溶解度高,對很多酶反應是惰性的,Tris也成了用于許多生(shēng)化目的非常滿意的緩沖液,也是目前用于分(fēn)子克隆中大(dà)多數酶反應的标準緩沖液。
緩沖pH範圍:
Tris爲弱堿,在常溫(25℃)下,它的pKa爲8.1,根據緩沖理(lǐ)論,Tris緩沖液的有效緩沖範圍在pH 7.1到9.1之間。0.1 M的水溶液pH爲10.4,一般加入鹽酸以調節pH值,即可(kě)獲得(de)所需pH值的緩沖液。但(dàn)同時應注意溫度對于Tris的pKa的影(yǐng)響對于 Tris 緩沖液,溫度每降低 1℃,pH 增加約0.03 個單位,濃度每稀釋 10 倍,pH 降低 0.03-0.05 個單位。對于精确應用,使用帶有玻璃/甘汞複合電極的經仔細校(xiào)正的 pH 計(jì)。
Tris緩沖液的優點:
1.Tris爲弱堿,可(kě)以隻用一種緩沖體(tǐ)系配制pH範圍由酸性到堿性的大(dà)範圍pH值的緩沖液,應用範圍廣。
2. Tris緩沖液對生(shēng)物化學過程幹擾很小,不與鈣、鎂離(lí)子及重金屬離(lí)子發生(shēng)沉澱。
3. Tris在水中溶解度高,對很多酶的反應是惰性的。
4. Tris緩沖能力高,在pH7.5-9.0之間有較強的緩沖能力。
5. Tris緩沖劑應用廣,在生(shēng)物化學、分(fēn)子生(shēng)物學、體(tǐ)外診斷、化妝品、塗料等領域發揮重要作(zuò)用。
Tris緩沖液的缺點:
1.在常溫(25℃)下,Tris的pKa爲8.1;根據緩沖理(lǐ)論,Tris緩沖液的有效緩沖範圍在pH7.1到9.1之間。實際操作(zuò)中,在pH值小于7.5和大(dà)于9.0時,Tris的緩沖能力是非常低的。
2.Tris緩沖液的pH值受溫度影(yǐng)響大(dà),△pKa/℃=-0.031 ,例如(rú):4℃時緩沖液的pH=8.4,則37℃時的pH=7.4,所以一定要在使用溫度下進行配制,室溫下配制的Tris-HCl緩沖液不能用于0-4℃。
3.濃度對Tris解離(lí)有顯著影(yǐng)響。例如(rú),10 mM和100 mM Tris溶液的pH值會相(xiàng)差0.1pH單位,溶液的濃度越大(dà)則其pH值越高。
4.Tris作(zuò)爲伯胺,在一定程度上與各種分(fēn)子反應,包括RNA酶抑制劑,醛,酶,DNA以及常見(jiàn)金屬如(rú)Cr2+,Fe3+,Ni2+,Co2+和Cu2+等,在有些系統中會起抑制作(zuò)用,在配制過程中需考慮與其他(tā)組分(fēn)之間的相(xiàng)互作(zuò)用。
5. Tris緩沖液易吸收空氣中的CO2,配制的緩沖液要注意蓋嚴密封。
6. Tris與許多類型含有亞麻纖維接頭的pH電極起反應,這種影(yǐng)響表現在電動勢(emf)漂移,平衡時間加長。因此,具有亞麻纖維接頭的電極不能精确測定Tris溶液的pH值。隻能使用具有陶瓷或玻璃接頭的電極測定Tris溶液的pH值。
7. Tris對許多哺乳動物有毒性。吸入、攝入、皮膚吸收Tris可(kě)造成傷害,操作(zuò)時需戴好手套和護目鏡;
8. 作(zuò)爲蛋白(bái)緩沖液時,若後續工(gōng)作(zuò)需要質譜,則不适宜用Tris,需換成其他(tā)質譜儀可(kě)耐受的緩沖液。
各種與Tris相(xiàng)關緩沖液的配制方法:
一、1×TBS的配制
1× TBS ( pH7.4 ) 的配制(0.02 M Tris,0.15 M NaCl,pH7.4):2.4 g Tris ( 三羟甲基胺基甲烷 ),8.76 g NaCl ,950 ml超純水, 磁力攪拌下滴加濃HCl至pH爲7.4,再加超純水定容至1000 ml,即可(kě)。如(rú)需含0.1% Tween-20,則在滴加HCl前先加入1ml Tween-20。
二、THB的配制
Tris-HCl緩沖液的兩種配置方法:
第一種方法是用Tris-HCl粉末(MW 157.6)和Tris粉末(MW 121.14)按照(zhào)不同比例混合,用水溶解即配成不同pH的Tris-HCl緩沖液。
另外一種方法是隻用Tris粉末,用鹽酸調節需要的pH值:以配置1 L 0.1 M的Tris-HCl緩沖液爲例:先稱12.11 g Tris堿溶于950 mL超純水中,邊攪拌邊滴加濃鹽酸,用pH計(jì)測定溶液所需的pH值,然後再加水補足到1 L即可(kě)。
配制50 mM Tris-HCl緩沖液 1升配制方法:
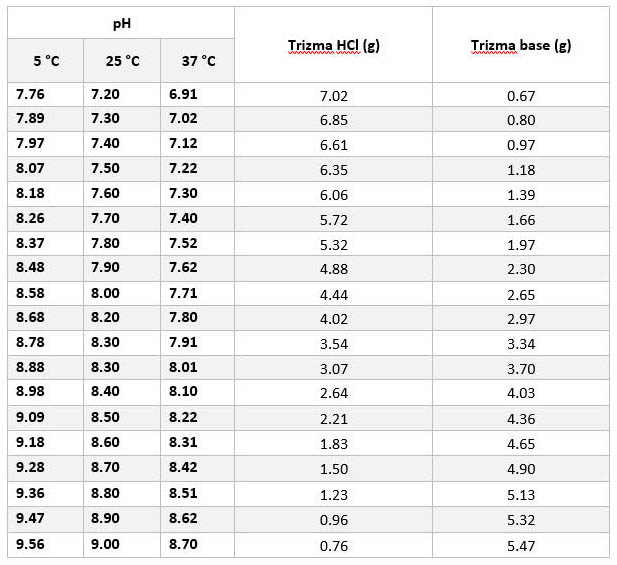
溫度對 50 mM Tris-HCl液pH值的影(yǐng)響
|
4℃
|
25℃
|
37℃
|
|
8.1
|
7.5
|
7.2
|
|
8.2
|
7.6
|
7.3
|
|
8.3
|
7.7
|
7.4
|
|
8.4
|
7.8
|
7.5
|
|
8.5
|
7.9
|
7.6
|
|
8.6
|
8.0
|
7.7
|
|
8.7
|
8.1
|
7.8
|
|
8.8
|
8.2
|
7.9
|
|
8.9
|
8.3
|
8.0
|
三、TBST緩沖液
TBST是TBS + Tween的縮寫,含有Tris-HCl,NaCl,Tween-20,是做Western Blot常用的一種洗膜緩沖液,1×TBST濃度爲0.02 M Tris,0.15 M NaCl,0.1% Tween-20,pH7.4。WB實驗中,爲了防止曝光(guāng)圖背景太高,在孵育時,混有Tween 的TBST 能洗掉PVDF膜上非特異性吸附的蛋白(bái)質。Tween是一種離(lí)子表面活性劑,有複性抗原作(zuò)用,可(kě)提高抗體(tǐ)特異性結合。TBST緩沖液于室溫儲存,若溫度過低,會産生(shēng)沉澱,可(kě)溶解或加熱(rè)後使用。
四、TE緩沖液
TE緩沖液是Tris-HCl緩沖液 + EDTA,1×TE濃度爲10 mM Tris-HCl,1 mM EDTA pH8.0。爲使用方便,TE緩沖液也可(kě)以配成10×或50×濃度。TE緩沖液是弱堿性,對DNA的堿基有保護作(zuò)用,因此,DNA在TE中的穩定性較好,不易被破壞完整性或産生(shēng)開環及斷裂,TE緩沖液被用于DNA的穩定和儲存。
五、TAE緩沖液
TAE緩沖液是将TE緩沖液中的鹽酸換成乙酸(Tris/Acetate/EDTA),50×TAE濃度爲2 M Tris-醋酸,100 mM EDTA,~pH8.5。TAE是使用最廣泛的緩沖系統。其特點是超螺旋電泳時更符合實際相(xiàng)對分(fēn)子質量,且雙鏈線狀DNA在其中的遷移率較快(kuài),電泳大(dà)于13 kb的片段時用TAE緩沖液将取得(de)更好的分(fēn)離(lí)效果,此外,回收DNA片段時也建議(yì)用TAE緩沖系統進行電泳。但(dàn)是,TAE的缺點是緩沖容量弱,長時間電泳不建議(yì)使用。
六、TBE緩沖液
TBE緩沖液是将TE緩沖液中的鹽酸換成硼酸(Tris/Borate/EDTA),5×TBE濃度爲445 mM Tris-硼酸,10 mM EDTA,~pH8.3。TBE緩沖液常用于丙烯酰胺電泳以及瓊脂糖凝膠電泳。TBE可(kě)用于長時間電泳,對較小片段分(fēn)離(lí)效果較好。但(dàn)是,超螺旋在TBE緩沖液中電泳時測出的相(xiàng)對分(fēn)子質量會稍大(dà)于實際分(fēn)子質量。另外,有文獻報道,硼酸會影(yǐng)響DNA的連接,如(rú)果要進行凝膠回收的話(huà),盡量不使用TBE緩沖液。