Blue Native PAGE凝膠電泳常見(jiàn)問(wèn)題
Blue Native PAGE凝膠電泳常見(jiàn)問(wèn)題
1. 在非變性條件(jiàn)下,使用Blue
Native PAGE凝膠進行非變性電泳比使用Tris-甘氨酸凝膠具有哪些優勢?
需要使用非離(lí)子洗滌劑進行增溶的樣品不能兼容傳統的非變性Tris-甘氨酸PAGE,因爲随着蛋白(bái)質在聚丙烯酰胺凝膠中的遷移,會将非離(lí)子洗滌劑遺留在條帶上方。當缺少非離(lí)子洗滌劑時,蛋白(bái)質會聚集并在泳道頂部形成垂直線條。當使用藍色非變性電泳(Blue Native PAGE凝膠)時,Coomassie G-250可(kě)顯著減少蛋白(bái)質的聚集,有效分(fēn)離(lí)膜上的蛋白(bái)質複合物,達到Tris-甘氨酸凝膠上得(de)不到的效果。此外,與Tris-甘氨酸系統的工(gōng)作(zuò)pH(pH 9.3–9.5)相(xiàng)比,Blue
Native PAGE凝膠較低的工(gōng)作(zuò)pH(pH 7.5–7.7)有助于維持堿性pH敏感型蛋白(bái)質的非變性結構和/或活性。
2. Blue
Native PAGE凝膠應如(rú)何保存?
我們推薦将其保存在4-8℃。不可(kě)冷(lěng)凍。
3. Blue
Native PAGE凝膠的蛋白(bái)分(fēn)離(lí)範圍是多少?
3-12%RealPAGE Native BN/CN 預制膠可(kě)分(fēn)離(lí)分(fēn)子量在45–10,000 kD範圍内的蛋白(bái)質。
4-16%RealPAGE Native BN/CN 預制膠可(kě)分(fēn)離(lí)分(fēn)子量在25–10,000 kD範圍内的蛋白(bái)質。
4. Blue
Native PAGE凝膠的推薦樣品上樣體(tǐ)積和蛋白(bái)質上樣量是多少?
我們提供的預制膠是12孔,每個孔的最大(dà)上樣體(tǐ)積爲30 μl,推薦每個泳道的蛋白(bái)含量範圍在20-50 μg。
5. 我的Blue Native PAGE凝膠在電泳過程中停止電泳了,爲什麽?該如(rú)何繼續電泳?
在Blue Native
PAGE凝膠電泳期間,電流下降至低于1 mA很常見(jiàn)。有些電泳電源如(rú)伯樂電源有負載檢查功能,電流過低(低于4mA) 會認爲沒有負載,報錯E1錯誤代碼,終止電泳。解決方法是更換電泳電源,如(rú)使用國(guó)産電源;另外可(kě)以調高電壓高于300 V,使得(de)電流不要低于4mA。

推薦使用RTD6137 非變性電泳蛋白(bái)質Marker(45-880 kD),RTD6142 高分(fēn)子量非變性電泳蛋白(bái)質Marker II(45-669 kD)或者RTD6144 寬分(fēn)子量非變性電泳蛋白(bái)質Marker 21-880 kD。然而由于凝膠濃度較低,低于45 kD條帶會壓在前沿,可(kě)能不可(kě)見(jiàn)。
在Blue Native
PAGE電泳中,不能使用預染分(fēn)子量Marker,因爲所有的預染蛋白(bái)分(fēn)子量Marker都(dōu)是經過變性和還(hái)原的,在非變性凝膠上不能良好分(fēn)離(lí)。
請(qǐng)注意,即使使用非變性分(fēn)子量Marker,在非變性電泳中的分(fēn)子量預估也是非常不精确的,因爲各蛋白(bái)質的不同電荷和結構會嚴重影(yǐng)響凝膠遷移。爲獲得(de)更精确的預估,可(kě)使用質譜分(fēn)析或排阻層析(SEC)。
7. 你(nǐ)們推薦對Blue Native PAGE凝膠使用哪種染色方法?
Blue Native PAGE凝膠可(kě)兼容大(dà)多數标準Coomassie
R-250或G-250染料配方。推薦使用FastBlue蛋白(bái)染色液(貨号:RTD6202)。
8.
5% G-250染料的作(zuò)用是什麽?是否含有洗滌劑?
5% G-250染料(貨号BC260)是一種濃縮型Coomassie G-250儲液,專爲與含有洗滌劑(非離(lí)子型)的Blue Native
PAGE凝膠電泳樣品一起使用而設計(jì)。該染料不含洗滌劑。正常情況下,非變性蛋白(bái)在凝膠上的遷移取決于凝膠緩沖液pH下的自(zì)然電荷/等電點,但(dàn)是,加入Coomassie G-250會使蛋白(bái)質産生(shēng)負電荷,即使是通常具有正電荷的高pI蛋白(bái)質也能帶上負電。該添加劑能夠與蛋白(bái)質非特異性結合,能夠保持蛋白(bái)的非變性狀态。
9. 你(nǐ)們推薦選擇哪種轉膜緩沖液用于Blue Native PAGE凝膠轉印?
我們推薦選擇10×BN轉膜緩沖液(貨号:BC600P)用于Blue Native PAGE凝膠轉印。PVDF是推薦使用的印迹膜,具有良好的轉印和檢測效果。硝酸纖維素膜(NC膜)不能兼容Blue Native PAGE凝膠轉印,這是因爲硝酸纖維素膜可(kě)與Coomassie
G-250染料發生(shēng)緊密結合,很難脫離(lí)幹淨。
10. 對于Blue Native PAGE凝膠,你(nǐ)們推薦的轉膜條件(jiàn)是什麽?
由于Blue Native
PAGE電泳基本關注的是分(fēn)子量比較大(dà)的蛋白(bái)或複合體(tǐ),推薦使用濕轉法轉膜,不推薦用半幹轉方法轉膜。使用BN轉膜緩沖液,以下轉膜條件(jiàn)僅供參考,客戶針對自(zì)己的目的蛋白(bái),最好經過1-2次預實驗後,确定最佳的轉膜條件(jiàn)。
|
蛋白(bái)大(dà)小
|
穩流
|
建議(yì)時間
|
降溫措施
|
|
低于70kD
|
150 mA
|
1 小時
|
不需要
|
|
70-300 kD
|
200 mA
|
1.5-2 小時
|
需要
|
|
高于300 kD
|
200 mA
|
2.5-3.5 小時
|
需要
|
11. 凝膠轉膜後,我的PVDF膜染上藍顔色了怎麽辦?
由于電泳緩沖液和上樣緩沖液中含有考馬斯亮藍G-250,凝膠轉膜後PVDF膜會有藍色痕迹,可(kě)以把膜浸泡在無水甲醇中漂洗幾分(fēn)鍾,去(qù)除藍色。
12. 非變性Marker轉到膜上看(kàn)不到條帶,Western Blot檢測後我如(rú)何判斷條帶大(dà)小呢(ne)?
有兩種方法可(kě)以解決非變性Marker轉膜後條帶顯示問(wèn)題:
第一種方法:凝膠轉膜後用麗春紅(hóng)染色液(貨号:RTD6301)染膜,可(kě)以看(kàn)到Marker條帶,順便可(kě)以檢測轉膜效率,然而要注意的是麗春紅(hóng)染色靈敏度比較低,可(kě)能不能完全看(kàn)到完整的Marker條帶。
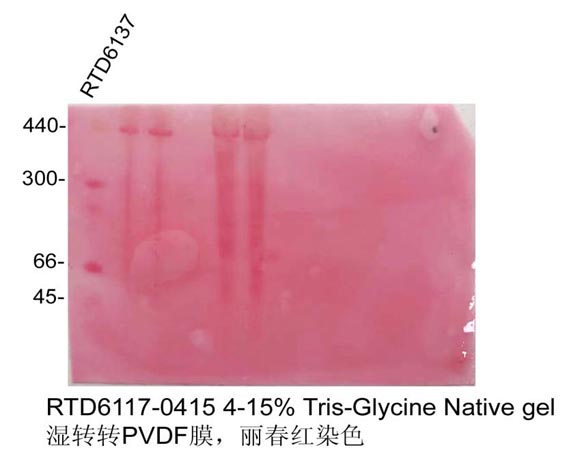
注:北京師(shī)範大(dà)學惠贈圖片
第二種方法(下圖):電泳結束後,把含有Marker泳道的凝膠切下,單獨用考馬斯亮藍染色液染色(貨号:RTD6202),剩餘的凝膠去(qù)完成轉膜到ECL發光(guāng)檢測過程,最後的發光(guāng)結果和Marker染色結果拼接判斷條帶範圍。
Jurkat細胞BN電泳 GAPDH檢測
電泳:1×藍色電泳緩沖液(含0.01% G-250)
穩壓150V 43分(fēn)鍾;1×無色電泳緩沖液 穩壓150V 35分(fēn)鍾
轉膜:1×BN轉膜緩沖液(不含甲醇),穩流200 mA
(電壓72-60V) 1.5小時,未冰浴
膜漂洗去(qù)藍色:PVDF膜無水甲醇浸泡10分(fēn)鍾至膜無色
封閉:無蛋白(bái)快(kuài)速封閉(貨号:
PF1070),RT,30分(fēn)鍾
一抗:GAPDH兔多抗(貨号:
RGA1040),1:5000 過夜孵育
二抗:羊抗兔IgG-HRP(貨号:
HGR1020) 1:5000 RT 1小時
ECL檢測:ECL發光(guāng)(貨号:
EC2520),曝光(guāng)3.5 min