精子鞭毛以“9+2”軸絲爲核心,環繞着中央2個單體(tǐ)微管的是9個外周二聯體(tǐ)微管(Doublet microtubule, DMT),其中A管爲完全微管,B管爲不完全微管。DMT中含有多種微管腔内結合蛋白(bái)(Microtubule inner protein, MIP),這些蛋白(bái)被推測對DMT的穩定性至關重要。哺乳動物精子DMT的特征是其複雜的築絲蛋白(bái)(tektin)束幾乎填滿了整個A管。在哺乳動物中發現了5種不同的tektin(tektin1~5)組成,tektin1~5基因敲除不同程度地影(yǐng)響了小鼠精子運動能力,研究人(rén)員(yuán)還(hái)在弱精子症患者中鑒定到了TEKT3基因突變。
2021年(nián),Gui M等人(rén)在Cell雜志發表文章(zhāng)[1]首次利用冷(lěng)凍電子顯微鏡(cryo-EM)解析了牛氣管纖毛的DMT結構,發現一種功能未知的新蛋白(bái),命名爲TEKTIP1(Tektin bundle interacting protein 1),其位于tektins束的中心,因此推定TEKTIP1可(kě)能發揮着組裝和/或穩定tektins束的關鍵功能。
陳蘇仁課題組利用CRISPR/Cas9基因編輯技術(shù)構建了Tektip1基因敲除小鼠,敲除鼠生(shēng)長發育正常但(dàn)雄性生(shēng)育力顯著降低,主要表現爲一定程度的精子軸絲結構破壞和精子運動軌迹改變(圖1)。
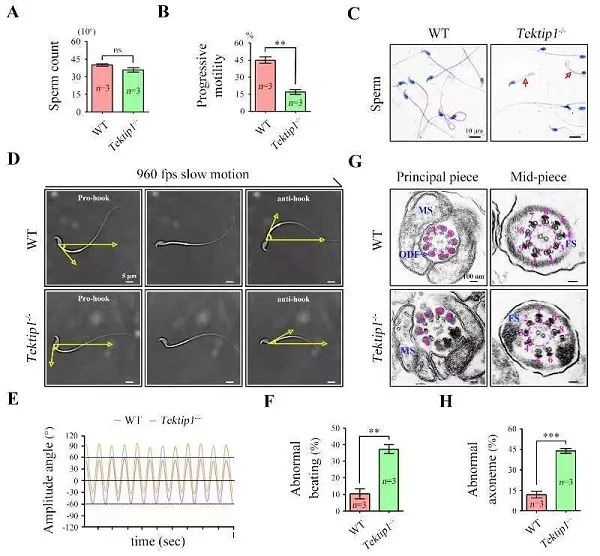
圖1. Tektip1基因敲除小鼠
精子運動軌迹和鞭毛軸絲結構